走进溶液世界》测试
1、单选题(每小题只有一个正确答案)
1.水是生命之源,下列有关水的说法正确的是
A.水资源可以循环借助,不必担忧淡水资源不足
B.水中有异味时可加入活性炭除味
C.用肥皂水区别硬水和软水,产生泡沫较多的是硬水
D.电解水生成氢气和氧气,说明水是由氢气和氧气组成
2.“落实科学进步观,节省保护水资源”。下列认识和做法不符合这一主题的是( )
A.洗菜、洗衣水用来浇花、冲卫生间
B.加大工业废水的排放监控,坚持达标排放
C.合理施用农药、化肥,降低水体污染
D.淡水资源取之不尽、用之不竭
3.用pH计测得一些物质的pH,下列说法正确的是
物质 | 苹果汁 | 西瓜汁 | 牛奶 | 鸡蛋清 | 炉具清洗剂 |
pH | 2.9 | 5.8 | 6.4 | 7.6 | 12.5 |
A.牛奶放置一段时间后变酸,pH变大
B.炉具清洗剂的碱性比鸡蛋清的碱性强
C.等量的西瓜汁比苹果汁所含氢离子数多
D.胃酸过多的人应该多喝苹果汁
4.运用图示法可以帮助大家巧学化学。下列化学常识用相应图示表示正确的是
A.![]()
B.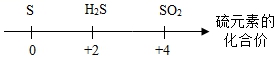
C.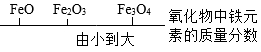
D.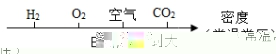
5.进行“肯定溶质水平分数的氯化钠溶液的配置”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是
A.称量固体时,氯化钠放在右盘 B.固体转移到烧杯时,氯化钠洒出
C.量取液体时,俯瞰读数 D.配好的溶液装瓶是,将溶液溅出
6.要配制100g 10%的氯化钠溶液,下列操作中会使所配溶液溶质水平分数偏大的是
A.氯化钠固体中含杂质
B.量取90mL水时,俯瞰读数
C.游码不在零处调节天平平衡后称量氯化钠
D.将配好的溶液倒入细口瓶中,瓶中原来有水
7.甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是()

A.T2℃时,甲乙溶液中溶质的水平分数肯定相等
B.T2℃时,150g甲的饱和溶液降温到T1℃,有20g固体析出
C.若丙中混有少量的甲,可用冷却热饱和溶液的办法提纯丙
D.T1℃时,乙的饱和溶液中溶质与溶液的水平比为3:7
8.小王同学需配制100g 12%的NaOH溶液来制作“叶脉书签”.在配制溶液过程中,下列做法正确的是
A.在托盘上垫上纸并称取12g NaOH固体
B.称量时发现指针向右偏转,应调节游码使天平平衡
C.用100mL量筒量取88mL水
D.把称取的NaOH固体直接倒入装有88mL水的量筒中溶解
9.关于水通电状况下实验现象描述正确的是
A.通电后,与正极相连的试管中可采集一种可燃性气体。
B.通电后,与负极相连的试管中的气体可使带火星的木条复燃。
C.正极上产生的气体与负极产生的气体的体积比为2:1
D.正极上产生的气体与负极产生的气体的体积比为1:2
10.下列关于水的说法正确的是()
A.经过沉淀、过滤、吸附后得到的矿泉水是纯净物
B.水体有肯定的自净功能,部分工业污水可直接排放
C.水是一种氧化物
D.水电解过程与电源正极连接的一端产生氢气
11.类比推理是化学学习中的一种要紧思维办法,以下类推结果正确的是()
A.室温下,pH值<7的溶液呈酸性,同理pH值<7的雨水是酸雨
B.CH4充分燃烧生成的H2O 和CO2,则充分燃烧生成H2O 和CO2的物质只含C、H 元素
C.肯定温度下的不饱和溶液还能溶解溶质,则肯定温度下的饱和溶液不可以溶解任何物质
D.CaO 与水反应生成Ca(OH )2,同理,Na2O与水反应生成NaOH
12.如图为A、B、C三种固体物质的溶解度曲线。下列有关说法错误的是
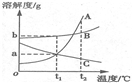
A.t1℃三种物质中B物质的溶解度最大
B.t2℃三种物质的饱和溶液中,溶质的水平分数最大的是A
C.t2℃时可用减少温度的办法使C的不饱和溶液变为饱和溶液
D.t1℃时,bgC物质完全溶解在100g水中,溶液水平为(100+a)g
13.身边的一些物质 pH 如下图,下列说法正确的是( )
A.pH 试纸润湿后测溶液酸碱度肯定偏小
B.用 pH 试纸测定卫生间清洗剂,其 pH=1.8
C.蚊虫叮咬后涂牙膏可减轻痛痒
D.橘子的酸性强于柠檬
14.分别用两种指示剂对下列四种溶液进行实验,滴加指示剂后溶液呈现的颜色不正确的一组是
实验编号 | 实验对象 | 滴加紫色石蕊试液 | 滴加无色酚酞溶液 |
A | 蒸馏水 | 紫色 | 无色 |
B | 稀硫酸 | 红色 | 无色 |
C | 氢氧化钠溶液 | 蓝色 | 红色 |
D | 硫酸钠溶液 | 紫色 | 红色 |
A.A B.B C.C D.D
2、填空题
15.转化:
不饱和溶液 饱和溶液
饱和溶液
结晶:从饱和溶液中得到晶体的过程,办法有:降温和_____。
16.冬季,大家常用甘油 溶液护肤,使皮肤维持湿润.溶质水平分数为80%的甘油溶液护肤成效最好。甘油溶液中的溶剂是______________。若想配500g80%的甘油溶液,则需甘油_______________g 。
17.实验结论:
(1)水通电能生成_____________。文字表达式:_____________。
(2)化学反应的实质:化学变化中分子________________;原子____________,只能________________。
(3)水分子是由_____________和____________构成的。
18.在空格中填入相应的仪器编号和名字。
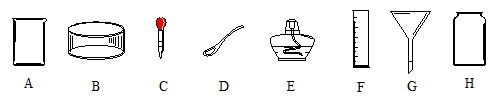
(1)用于取用粉末状固体的仪器(填编号,下同) ___________,名字是______________;
(2)用于制作过滤器的仪器是 ____________,名字是____________;
(3)用于量取适量液体的仪器是_________,名字是_________;读数时,视线要与________相平。
19.某注射用药液的配制办法如下:
①把![]() 药品溶于水配制成
药品溶于水配制成![]() 溶液
溶液![]() ;
;
②取![]() 溶液
溶液![]() ,释至
,释至![]() ,得溶液
,得溶液![]() ;
;
③取![]() 溶液
溶液![]() ,加水稀释至
,加水稀释至![]() ,得溶液
,得溶液![]() ;
;
④取![]() 溶液
溶液![]() ,加水稀释至
,加水稀释至![]() ,得溶液
,得溶液![]() 。
。
因为在整个配制过程中药液非常稀,其密度都可近似看做![]() 。则最后得到的药液(溶液
。则最后得到的药液(溶液![]() )中溶质的水平分数为____________。
)中溶质的水平分数为____________。
3、判断题
20.思维导图是激起大脑潜能、练就科学思维的有效办法。A~D 是初中化学容易见到的四种物质,其中 B、D 常温时为液态,且组成元素类型相同。(图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。)
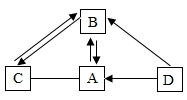
(1)写出 D 的化学式:________。
(2)写出 A 与 C 反应的文字表达式:________。
21.A、B、C、D、E、F、G是初中化学容易见到的物质,A在常温下是一种无色液体,D俗称为酒精,G是大理石的主要成分。它们之间的转化关系如图所示:
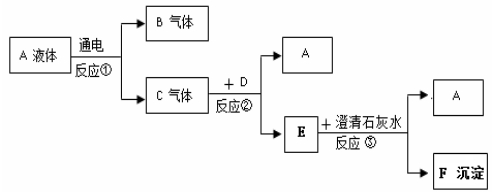
请回答:
写出下列物质的化学式:A____________ 、D____________ 、E____________;
写出反应①的化学方程式:______________________________________ ;
写出反应②的化学方程式:______________________________________ ;
写出反应③的化学方程式:______________________________________ ;
点燃B之前必须要_______________________________________________ 。
4、实验题
22.石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。
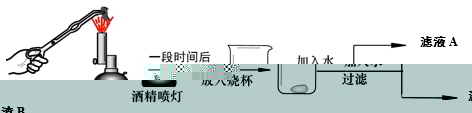
① 煅烧石灰石的化学方程式为____________________;
② 借助滤液A或滤渣B设计策略证明石灰石分解状况。
实验操作 | 判断依据 | 结论 |
_________ | __________ | 石灰石已分解 |
________ | ___________ | 石灰石完全分解 |
23.现有下列四套容易见到的实验装置,请按需要填写下列有关空格:
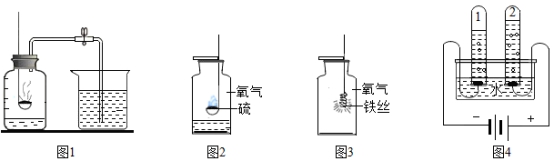
图1实验是借助可燃物消耗瓶内的氧气,使瓶内____,通过进入集气瓶的水的体积来推断空气中氧气的含量。
图2实验中,水有哪些用途为_____。
图3集气瓶中应预先__,该实验可看到的现象是__,该反应化学方程式为__。
图4实验过程中,试管1中产生的气体是___。
上述四个实验中研究物质组成的实验是___、___。
5、计算题
24.某化学兴趣小组欲测定一瓶过氧化氢溶液中过氧化氢的水平分数,取2g二氧化锰和68g过氧化氢溶液在烧杯中混合,完全反应后烧杯内剩余物质的总水平为68.4g,求:
(1)反应中生成氧气的总水平__________g;
(2)计算这瓶过氧化氢溶液中过氧化氢的水平分数__________。
25.小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的水平分数进行测试,使用了以下的方法:取用8 g这种石灰石样品,把40 g稀盐酸分四次加入,测量过程所得数据见下表。请计算:
序号 | 加入稀盐酸水平 | 剩余固体水平 |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)8 g的石灰石样品中含有杂质多少克? _________
(2)样品中碳酸钙的水平分数是多少? ___________
(2)上表中m的数值应为多少? _________________
(2)要得到280 kg的CaO,需要水平分数为80%的石灰石多少千克? ___________
参考答案
1.B 2.D 3.B 4.A 5.D 6.B 7.B 8.C 9.D 10.C 11.D 12.C 13.C 14.D
15.恒温蒸发溶剂
16. 水 400
17.氢气和氧气 水![]() 氢气
氢气![]() 氧气 分成原子 不可以再分 重新组合成新的分子 氢原子 氧原子
氧气 分成原子 不可以再分 重新组合成新的分子 氢原子 氧原子
18.D 药匙 G 漏斗 F 量筒 液体凹液面最低处
19.0.1%
20.H2O2 氧气+氢气![]() 水
水
21. H2O C2H5OH CO2 略 略 CO2+Ca2=CaCO3↓ +H2O 检验气体的纯度
22.CaCO3 ![]() CaO+CO2↑ 取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊) 取滤渣B少量于试管中,滴加足量盐酸 无气泡
CaO+CO2↑ 取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊) 取滤渣B少量于试管中,滴加足量盐酸 无气泡
23.压强减小 吸收二氧化硫,预防其污染空气 装少量水 细铁丝剧烈燃烧,火星四射,放出很多的热,生成一种黑色固体 3Fe+2O2![]() Fe3O4 氢气 图1 图4
Fe3O4 氢气 图1 图4
24.1.6 5%
25.1.2 g 85% 3 625 kg







